| Tomografía computada: diagnóstico de las
complicaciones locales, evaluación de la gravedad de la pancreatitis aguda Utilización como índice pronóstico En 1984 Kivisaari y col22 describen la técnica de tomografía computada con contraste endovenoso en bolo para el diagnóstico de la necrosis pancreática. Ranson y Balthazar 4.41 en 1985 publican una correlación entre los hallazgos tomográficos y la incidencia de complicaciones locales y mortalidad pero sin utilizar la técnica dinámica sino con contraste endovenoso administrado convencionalmente por lo cual no se puede valorar la magnitud de la necrosis pancreática sino fundamentalmente las características del páncreas y la afectación del tejido peripancreático que ellos denominan flemón (cuadro 7), término que como ya mencionamos no debe utilizarse según el Simposio de Atlanta.
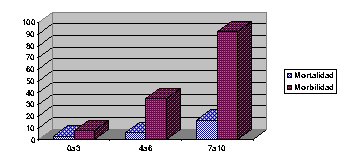
P: pseudoquiste; +: fallecido sin absceso. En 1986 el grupo de la Universidad de Ulm publica su experiencia sobre el valor de la TC dinámica para diagnosticar la magnitud de la necrosis pancreática9. Existe una correlación entre la magnitud de la necrosis y el riesgo de complicaciones locales infecciosas y el objetivo del grupo de Beger consistía en hallar un criterio para indicar un tratamiento conservador o un tratamiento quirúrgico. Dos conclusiones de este trabajo son importantes: ni los datos clínicos ni los criterios de Ranson pueden dar una idea fidedigna de las alteraciones morfológicas a nivel del páncreas y del tejido peripancreático y que la TC dinámica tiene sus limitaciones en el sentido que no tiene 100% de sensibilidad y especificidad sobre todo en caso de déficits menores en la perfusión pancreática: puede existir una subvaloración de lo que realmente acontece o por el contrario que no exista necrosis en absoluto, por lo cual el seguimiento tomográfico ayuda a tomar una conducta terapéutica. En 1990 Balthazar5 publica los resultados de la conjunción de sus criterios descriptos en 1985 y los de la Universidad de Ulm. El problema que se planteaba con la clasificación en grados tomográficos (A-E) era que si bien se identificaba un grupo de pacientes con elevado riesgo de presentar complicaciones sépticas, una gran cantidad con grados D y E evolucionaban hacia la reabsorción de las colecciones y por otro lado un porcentaje de pacientes que presentaba complicaciones no eran identificados. Con la TC dinámica se clasificó a los pacientes según la magnitud de la necrosis pancreática en aquéllos con 30%, 50% o más del 50% de necrosis glandular. En el cuadro 9 se puede observar los puntajes del nuevo score denominado Indice de Severidad Tomográfica según el porcentaje de necrosis de la glándula y los Grados Tomográficos de Balthazar. En este trabajo se observó que la mortalidad se relaciona con la existencia de una necrosis glandular y que las complicaciones locales infecciosas se constatan fundamentalmente en pacientes con necrosis pancreática pero también en un subgrupo de pacientes sin grandes repercusiones en el ámbito glandular pero con colecciones peripancreáticas (grupos D y E) es decir que las variables a tener en cuenta como predictoras de complicaciones son la necrosis glandular y la existencia de colecciones peripancreáticas. El valor predictivo positivo para el desarrollo de una complicación local séptica es del 84% en los pacientes con necrosis glandular y colecciones peripancreáticas (grados D y E, flemon), del 77% en los que presentan sólo necrosis y del 46% en los que tienen solamente colecciones peripancreáticas. El valor predictivo negativo es del 95%, 97% y 96% respectivamente: si el paciente no presenta colecciones y/o necrosis pancreática la posibilidad de que desarrolle una complicación local infecciosa es baja. Los pacientes que presentaron un páncreas con un refuerzo normal en la TC dinámica realizada al ingreso tuvieron una mortalidad del 4% y estas muertes se observaron en pacientes que desarrollaron una necrosis glandular tardía, constatada en las TC dinámicas de control efectuadas entre la 1° y 2° semana y característicamente todos presentaban imágenes tomográficas al ingreso grados D y E. En cuanto a la magnitud de la necrosis, aquellos pacientes con escaso porcentaje de tejido pancreático necrótico presentó 0% de mortalidad y 40% de morbilidad; los pacientes con una necrosis pancreática del 30% o mayor presentó una morbilidad del 94% y una mortalidad del 29%. Cuando la falta de refuerzo glandular en la TC dinámica compromete menos del 30% de la glándula, el estudio pierde fidelidad y se ha observado falta de correlación entre las imágenes y los hallazgos intraoperatorios. En la figura 3 se puede observar la morbilidad y la mortalidad en relación al nuevo score creado denominado Indice de Severidad Tomográfica (CT Severity Index). Los pacientes con 0 y 1 punto no presentaron morbilidad ni mortalidad y los pacientes con un puntaje de 2, 0% de mortalidad y 4 % de morbilidad; la mortalidad se observo en aquéllos con un índice de severidad de 3 o más puntos.
En cuanto a la predicción de la formación de abscesos, once variables fueron seleccionadas con capacidad predictiva individual: la falta de visualización de la vena porta y/o de la vena esplénica, las colecciones en los espacios pararrenales posteriores derechos o izquierdos, en el mesocolon transverso, en el mesenterio o en la pelvis, la presencia de burbujas, la heterogeneicidad de las colecciones extrapancreáticas, la infiltración de la pared abdominal y el grado E de la clasificación tomográfica de Balthazar-Ranson. En el análisis multivariado 3 de ellas fueron seleccionadas, la presencia de las mismas implicaron una duplicación del riesgo de presentar un absceso: la falta de visualización de la vena esplénica, las colecciones en el espacio pararrenal posterior derecho y la heterogeneicidad de las colecciones extrapancreáticas. Como se puede apreciar son numerosos los esfuerzos que aún se realizan con el fin de lograr predecir el riesgo de infección (debido a que es la causa más importante de muerte en las pancreatitis agudas graves) y el riesgo de fallecer. ¿Se puede determinar con certeza si el Sindrome de Respuesta Inflamatoria Sistemica es por infeccion de la necrosis o provocado por la necrosis misma (esteril)? En primer lugar debemos aceptar que no existen signos clínicos ni tomográficos certeros que permitan confirmar una necrosis infectada o un absceso pancreático. Las burbujas en la TC y el empeoramiento clínico no permiten inferir esto con certeza. La única manera de confirmar la infección pancreática es mediante el estudio bacteriológico del material obtenido mediante PAF guiada por TC o ecografía. El material obtenido se estudia mediante técnica de Gram y si es positivo el paciente debe ser operado, si es negativo se espera el cultivo. Tiene una especificidad del 100% y una sensibilidad del 80 al 95 %. Es un método seguro y sencillo. En el Hospital Durand no efectuamos PAF, la falta de mejoría clínica a pesar del tratamiento de sostén intensivo o el empeoramiento del estado general objetivado con el score APACHE II son criterios para valorar el proceso inflamatorio mediante una TC dinámica y operar al paciente, descartados otros focos sépticos capaces de descompensar al paciente. Una forma segura e incruenta de confirmar un foco infeccioso o detectar la traslocación bacteriana a punto de partida intestinal es la detección en la sangre de ADN microbiano mediante PCR (polymerase chain reaction); su aplicación clínica comienza a ser analizada23.50.TRATAMIENTO DE LAS PANCREATITIS AGUDAS GRAVES Antagonistas de los receptores Histamina2 En un trabajo sobre pancreatitis aguda presentado en la Academia Argentina de Cirugía en 199314 habíamos expresado en el cierre de la discusión nuestro temor ante el uso de antagonistas de los receptores Histamina2 en forma indiscriminada. La asociación de estos bloqueantes, antibióticos administrados no racionalmente, la falta de aporte de glutamina y de nutrición enteral nos parecía crítica en cuanto al riesgo de sobrepoblación bacteriana con gérmenes intrahospitalarios resistentes a nivel del tubo digestivo y la posibilidad de traslocación. O’Keefe y col32 han corroborado un aumento en la incidencia de complicaciones sépticas en pacientes críticos a los cuales se les indicaba ranitidina respecto de aquéllos a los que se les administraba sucralfato. Decontaminacion selectiva y profilaxis antibiotica Las complicaciones locales sépticas en las pancreatitis agudas graves son responsables del 80% de la mortalidad. ¿Puede evitarse la infección de la necrosis que inicialmente siempre es estéril? Antibioticoterapia profiláctica El rol de la antibiótico profilaxis en las pancreatitis agudas necróticas es aún tema de debate. Numerosos trabajos fracasaron en demostrar la prevención de la infección de la necrosis pancreática y peripancreática mediante el uso profiláctico de antibióticos. Actualmente se conocen los gérmenes que habitualmente infectan la necrosis (Escherichia Coli, Enterococo, Pseudomona, Klebsiella, Serratia, Bacteroides, Cándida) y los antibióticos que llegan al tejido pancreático: el Imipenem cumple ambos requisitos. Pederzoli y col en un estudio prospectivo y randomizado utilizan el imipenem desde el comienzo de la enfermedad a una dosis de 0,5 g. ev c/8horas. por un lapso de 14 días versus un grupo control. El grupo tratado con imipenem presentaba un porcentaje mayor de pacientes con una necrosis pancreática superior al 50% que el grupo no tratado (34,1 vs 6%). A pesar de ello se constato una menor incidencia de infecciones pancreáticas y no pancreáticas (respiratorias, urinarias, etc.) significativas y una menor mortalidad en el grupo tratado con Imipenem que si bien no es estadísticamente significativo debemos recordar que el número de pacientes con necrosis pancreática extendida era mayor en el grupo tratado que en el control37. Decontaminación selectiva La decontaminación selectiva mediante norfloxacina, colistina y anfotericina por vía oral y rectal logró en un estudio prospectivo reducir la mortalidad global y particularmente la mortalidad tardía (luego de la segunda semana), relacionada a una significativa reducción de las infecciones pancreáticas cuando se la comparó con un grupo control. Se constató incluso una disminución significativa del número de laparotomías por paciente26. Se ha comprobado que la infección de la necrosis por un germen es precedida por la colonización previa del tubo digestivo por dicho germen lo cual avala la hipótesis del origen intestinal de los microorganismos que infectan la necrosis. Conclusión
Lavado peritoneal La sospecha de una acción beneficiosa del lavado peritoneal en las pancreatitis agudas se remonta a la década del ‘60. En 1976 Ranson observa una mejoría sustancial en la fisiología respiratoria y cardiovascular con los lavados peritoneales iniciados dentro de las 48 horas de instalada la enfermedad y realizados diariamente durante 2 a 4 días, con una reducción de la mortalidad temprana (la relacionada con el Síndrome de Respuesta Inflamatoria Sistémica [SIRS]) pero no con la mortalidad alejada (relacionada con las complicaciones sépticas). La mejoría se relacionaría con la eliminación de la cavidad abdominal de amilasa, lipasa, fosfolipasa A2, complejos proteasas-antiproteasas, tripsinógeno, proenzimas proteolíticas, prostaglandinas, etc. Se constató experimentalmente que este exudado es capaz de producir hipotensión arterial, liberación de histamina, aumento de la permeabilidad vascular e inhibición de la función mitocondrial en el hepatocito. Estudios experimentales en animales demuestran una mejoría y reducción de la mortalidad con el lavado peritoneal. El agregado de aprotinina (inhibidor de las proteasas) en el líquido de lavado peritoneal no demostró en los pacientes tratados ninguna mejoría. Otros autores16 coinciden en los beneficios si el procedimiento se inicia precozmente con disminución del dolor abdominal, mejoría de la fisiología respiratoria, elevación de la calcemia, estabilización del hematocrito, corrección del medio interno: la mejoria clínica fue objetivada mediante el score APACHE II.Mayer, Mc Mahon, Imrie28 en un trabajo multicéntrico no corroboran estos resultados pero esto podría ser debido al retraso en la implementación del lavado peritoneal en algunos de los pacientes por mencionar algunos de los errores metodológicos que se desprenden de dicha publicación. Ranson posteriormente va más allá de los beneficios tempranos del lavado peritoneal, observando una reducción en las complicaciones sépticas del páncreas y en la mortalidad, fundamentelmente en pacientes con un score de Ranson igual o mayor de 5 y scores tomográficos grados D y E cuando el lavado peritoneal iniciado dentro de las 48 horas se prolonga por 7 días40. El número de pacientes es escaso para lograr cifras significativas si bien se observa una tendencia hacia este beneficio en cuanto a morbimortalidad tardía. El trabajo no logra aclarar la controversia en cuanto a los beneficios del lavado peritoneal e incluso no se comprende cuál sería el mecanismo por el cual desencadenaría estas buenas respuestas tardías. Las complicaciones relacionadas con el método abarcan lesiones viscerales, aumento de la dificultad respiratoria por aumento de la presión intraabdominal debido al fluído introducido, sobrecarga hídrica y eventración en el ámbito de la incisión realizada para introducir el catéter. En conclusión, el lavado peritoneal constituye aún un tema de controversia en cuanto a su utilidad si bien existe una tendencia a aceptar que resultaría beneficioso durante la etapa de SIRS. Hemofiltracion y hemodiafiltracion Muy útiles para la remoción de citoquinas lo cual se traduce en una mejoría hemodinámica y de otras fallas orgánicas. En nuestra experiencia hospitalaria hemos comprobado en pacientes con asistencia respiratoria mecánica por distress respiratorio, hipotensión arterial sostenida y con ictericia por hígado de sepsis la mejoría clínica con extubación, el cese de los requerimientos de dopamina y la disminución de los valores de bilirrubinemia. La indicación de hemofiltración o hemodiafiltración depende de la coexistencia de una insuficiencia renal aguda. Dados estos resultados obtenidos creemos que constituye uno de los más importantes avances para lograr el soporte clínico del paciente con una pancreatitis aguda grave ya sea en la etapa de Síndrome de Respuesta Inflamatoria Sistémica o en la etapa de sepsis cuando se infecta la necrosis. Bloqueantes del proceso inflamatorio sistemico En las pancreatitis agudas graves, con necrosis glandular experimental en ratas, el bloqueo de la acción de la Interleuquina-1 (ya sea mediante antagonistas o lo observado en ratas carentes del receptor tipo 1 de la IL-1) se traduce en:
Los hallazgos orientan a que un bloqueo temprano de la cascada inflamatoria desencadenaría dos fenómenos diferentes pero interrelacionados entre sí: un bloqueo de las manifestaciones sistémicas de la pancreatitis aguda grave y un bloqueo en el progreso inflamatorio local pancreático. En cuanto a esto último, se sospecha que una vez desencadenada la pancreatitis aguda el bloqueo citoquínico reduciría la infiltración de linfocitos y macrófagos con disminución de la producción local de citoquinas (corroborado experimentalmente) lo cual colaboraría en reducir la progresión del proceso inflamatorio y de autodigestión glandular; si bien no se impide la formación de edema, vacuolización y necrosis, estos se reducen significavamente. Somatostatina Basados en el concepto de la autodigestión pancreática y de la grasa peripancreática, así como del teórico desequilibrio entre proteasas y antiproteasas en el ámbito circulatorio, el uso de somatostatina estaría justificado ya que tanto ella como su derivado sintético (octreótido) disminuyen la secreción pancreática exócrina. A pesar de ello los estudios experimentales en animales demuestran resultados variables desde marcadamente beneficiosos hasta nulos. En los humanos se observa la misma variación 20.36 pero debemos considerar que muchos de estos trabajos presentan o bien un escaso número de pacientes, falta de un grupo control o la inclusión de formas leves que obviamente se autolimitan espontáneamente. Un estudio prospectivo, randomizado en el cual se evaluó la eficacia de la somatostatina indicada desde el inicio de la enfermedad en pacientes con formas graves demostró una reducción de las complicaciones sépticas en tanto que la menor incidencia del síndrome de dificultad respiratoria del adulto y una menor mortalidad no llegaron a diferencias significativas posiblemente por un error estadístico tipo II36. Aún no está confirmada la utilidad de la somatostatina como medicación capaz de cambiar el curso evolutivo de las formas graves. Rol de la colangiografia endoscopica retrograda y de la esfinteropapilotomia La impactación de un cálculo en el extremo distal de la vía biliar en pacientes con canal biliopancreático común y reflujo biliar hacia el conducto pancreático es una teoría aceptada generalmente para explicar el origen biliar de las pancreatitis agudas. Lo que aún resulta controvertido es atribuir al tiempo de obstrucción biliar una relación directa con la progresión hacia una forma grave de la enfermedad1: hay autores que avalan esta posición y otros que la niegan. En nuestra experiencia observamos que la mayoría de los pacientes con una pancreatitis aguda grave de origen litiásico presentan una migración espontánea temprana de los cálculos hacia el duodeno. La sospecha de una impactación sostenida del cálculo traducida en una elevación progresiva de la bilirrubina y la fosfatasa alcalina o un cuadro clínico compatible con una colangitis aguda nos obliga a confirmar el diagnóstico y tomar una medida terapéutica. Ese es el momento de indicar una colangiografía endoscópica retrógrada: confirma el diagnóstico y constituye una medida terapéutica que además evita la cirugía, lo cual sería beneficioso si coincidimos en que una cirugía temprana en una pancreatitis aguda grave altera el curso natural de la enfermedad aumentando las complicaciones pancreáticas sépticas y la mortalidad. Nuestras esperanzas estan volcadas en la colangiorresonancia, que permitirá estudiar el proceso de migración de los cálculos y efectuar el diagnóstico en forma no cruenta, reservando el procedimiento endoscópico para aquéllos que realmente lo necesiten. Creemos que así como la TC dinámica permitió conocer el proceso inflamatorio y el desarrollo de la necrosis pancreática que no podía ser valorada por el aspecto externo de la glándula hallado por el cirujano durante la laparotomía en décadas pasadas34, la colangiorresonancia magnética nuclear contribuirá en el esclarecimiento de la evolución natural de los cálculos en la vía biliar principal, su correlación con el proceso inflamatorio pancreático y colaborará en aclarar definitivamente la veracidad o falsedad de la hipótesis del cálculo enclavado en la papila como la causa de progresión de la pancreatitis aguda hacia una forma grave. Nutricion El soporte nutricional constituye un tema muy importante en las pancreatitis agudas graves tanto en pacientes previamente bien nutridos como suele observarse en aquéllos que padecen una pancreatitis aguda de etiología litiásica como en los mal nutridos como frecuentemente se observa en los pacientes con pancretitis agudas de origen alcohólico. Existe un metabolismo similar al de los cuadros sépticos39. Los pacientes que a pesar de una nutrición intensiva permanecen con balance nitrogenado negativo presentan una mayor tasa de mortalidad. Los aminoácidos de cadena ramificada se encuentran en concentraciones disminuidas y los aromáticos aumentados como en otros estados hipercatabólicos. Debido a que los primeros son utilizados para la gluconeogénesis sería importante un mayor aporte de los mismos. El soporte nutricional debe iniciarse una vez estabilizado al paciente desde el punto de vista hemodinámico y respiratorio. En un comienzo la nutrición debe ser parenteral total (NPT) debido al íleo paralítico. Una vez recuperado el tránsito intestinal la nutricion enteral total (NET) puede instaurarse a partir de una sonda nasoyeyunal (cuya colocación es dificultosa y frecuentemente requiere de la colaboración del endoscopista) o de una yeyunostomía en el caso que el paciente haya sido operado. La glutamina es un aminoácido que cumple funciones muy importantes, no es un aminoácido esencial pero en estas condiciones clínicas se comporta como condicionalmente esencial ya que la síntesis endógena es insuficiente; actualmente se considera fundamental su aporte en el paciente crítico. La administración parenteral de glutamina es complicada por su inestabilidad en las soluciones acuosas, no así en las soluciones enterales. El aporte parenteral de grasas debe ser suficiente para evitar deficiencias de los ácidos grasos esenciales. Su administración parenteral no estimula la secreción pancreática exócrina por lo cual no es riesgosa en las pancreatitis agudas graves litiásicas o alcohólicas. Si bien no hay datos sobre la exacerbación de las pancreatitis agudas de origen hiperlipémico por la infusión de grasas existen centros que consideran poco prudente su administración en estos casos. En nuestra experiencia, la yeyunostomía de alimentación efectuada en el momento de la necrosectomía simplifica enormemente la nutrición y conlleva beneficios que se comentan en un párrafo posterior. El aporte proteico debe estar basado en aminoácidos libres y péptidos pequeños que se absorben directamente. La administración de grasas por vía enteral debe ser reducida a pesar de que la vía de alimentación sea yeyunal para evitar un posible estímulo pancreático. Debe estar constituida por triglicéridos de cadena intermedia que no estimulan al páncreas y se absorben directamente. En ocasiones es útil agregar enzimas pancreáticas en las soluciones enterales para evitar cuadros de malaabsorción. Tanto la NPT como la NET son efectivas pero la NET tiene ventajas evidentes e indiscutibles:
Cirugia Qué se debe operar y cuándo. Necrosis estéril, necrosis infectada, absceso pancreático. La infección de la necrosis es la responsable del 80% de las causas de muerte en las pancreatitis agudas graves. Actualmente no se discute la necesidad de efectuar una toilette en estos pacientes: sin cirugía la mortalidad es del 100%. La resección de los tejidos necróticos, se denomina necrosectomía.Según mencionamos previamente existen 2 tendencias3: unos centros solamente operan las complicaciones sépticas (necrosis infectada, absceso pancreatico)10 y otros centros hallan beneficios en cuanto a la reducción de la mortalidad al operar los pacientes con una necrosis estéril pero extensa (>50% de la glándula) y con scores elevados de APACHE II42.43.Obviamente el médico de la unidad de terapia intensiva no necesita conocer todos los detalles de técnica quirúrgica, pero sí los fundamentos de cada una de ellas ya que se enfrentará ante un paciente con un abdomen abierto y un packing de gasas, con tubos de drenaje para el lavado continuo, con exploraciones abdominales reiteradas, etc. y debe conocer los resultados obtenidos con cada uno de estos procedimientos, sus posibles complicaciones, las ventajas y desventajas. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||