|
Necrosectomía
Las resecciones pancreáticas2.38 (esplenopancreatectomías
izquierdas, esplenopancreatectomías casi totales, duodenopancreatectomías cefálicas)
son intervenciones que actualmente no se practican, se consideran gestos quirúrgicos
excesivos e injustificados. Constituyen intervenciones con un elevado riesgo quirúrgico
al practicarse en pacientes críticos, en los cuales se resecan porciones de páncreas
sano27. La mortalidad promedio se eleva a un 40%. No se pueden justificar por
los hallazgos intraoperatorios ya que el aspecto externo de la glándula y del tejido
peripancreático no se correlaciona con la afectación intraparenquimatosa. La tomografía
computada dinámica nos ha ayudado a comprender esta realidad y valorar más precisamente
los tejidos afectados de aquéllos que aún se encuentran vitales.
En contraposición a las resecciones pancreáticas surge la "necrosectomía"
que consiste en resecar los tejidos necróticos, respetando los sanos y vascularizados,
así como la evacuación de todas las colecciones. Es una toilette que se efectúa
mediante digitoclasia, sin instrumental ya que la palpación logra identificar estructuras
nobles (vena esplénica, vena mesentérica superior, etc.) que quedan ocultas y rodeadas
de este tejido necrótico que característicamente tiene un color gris e incluso negruzco
(figura 4).
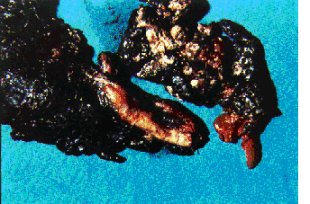
Figura
4
Necrosectomía: restos de páncreas necrótico que incluye en esta
ocasión unos centímetros de vena esplénica que accidentalmente fue lesionada. En este
paciente la necrosetomía implicó casi todo el páncreas ya que los tejidos necróticos
resecados abarcan desde el bazo hasta la vena mesentérica superior y la vena porta que
quedaron al descubierto.
Esta
técnica no es cuestionada pero la experiencia ha demostrado que frecuentemente es
incompleta en un único acto quirúrgico y que la necrosis retroperitoneal tiende a
continuar y propagarse posiblemente por la presencia de jugo pancreático (resultado de
las efracciones de los canales pancreáticos) que baña constantemente los tejidos
retroperitoneales. Por este motivo la laparotomía con necrosectomía, drenajes cerrados
convencionales y cierre de la lararotomía está asociada a la necesidad de
reexploraciones por cuadros sépticos a repetición ya que los drenajes convencionales son
inadecuados para eliminar restos de necrosis hasta en un 50% de los pacientes. Cerrar una
cavidad peritoneal infectada y con inevitables restos necróticos es responsable de los
cuadros sépticos que descompensan al paciente y terminan desencadenando un agravamiento
del estado general que finalmente es imposible de revertir: se debe evitar a toda costa la
prolongacion de los estímulos que desencadenan el SIRS y la sepsis. Con esta técnica el
75% de los pacientes que fallecen es por persistencia o recurrencia de la infección.
Para evitar estas recurrencias y persistencias de focos sépticos se
han delineado fundamentalmente dos tendencias terapéuticas: la necrosectomía, con sutura
de la laparotomía y un lavado postoperatorio continuo de la retrocavidad de los epiplones
propuesto por el grupo quirúrgico de la Universidad de Ulm7.8 y la
necrosectomía, con drenaje abierto con reexploraciones planeadas cada 48-72 horas
propuesto por Bradley III12.15.35.
La técnica del lavado local continuo con 7 litros diarios promedio se
realiza a través de dos drenajes de doble lumen que se ubican en la retrocavidad de los
epiplones y que se exteriorizan por contrabertura en ambos flancos. El lavado se prolonga
hasta obtener un líquido con nulo o escaso material desvitalizado, normalización de las
concentraciones de enzimas pancreáticas dosadas en el líquido y la desaparición de los
signos de actividad de la pancreatitis aguda. Ya que la necrosis e infección pueden
propagarse hacia el mesenterio, el mesocolon transverso y por el tejido retroperitoneal
posterior al colon ascendente y descendente, la pregunta que uno se plantea es si el
lavado postoperatorio puede ser considerado suficiente ya que solo abarca la retrocavidad.
Con relación a esto, la mortalidad del grupo de la Universidad de Ulm es del 14%, pero
otros centros con este mismo procedimiento no han podido lograr los mismos resultados
variando la mortalidad entre el 21 y 28%. Puede constatarse con la técnica del lavado la
formación de abscesos, hemorragias locales o difusas y fístulas intestinales.
El drenaje abierto pregonado por Bradley III15
y comenzado a realizar en el Hospital Durand en la década del 6014, implica
mantener separados mediante gasas (en nuestro caso mediante guantes de goma) el estómago
en sentido cefálico y el colon transverso en sentido caudal de tal manera que la
retrocavidad de los epiplones queda en comunicación con el exterior al finalizar la
necrosectomía. Bradley III sistematiza unas curaciones
repetidas cada 48-72 horas para efectuar necrosectomías reiteradas. Estas primeras
toilettes se realizan en el quirófano y posteriormente cuando el tejido de granulación
va extendiéndose por el retroperitoneo se realizan en la unidad de cuidados intensivos.
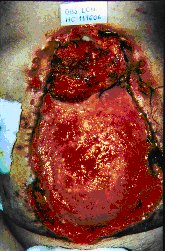
La brecha operatoria cicatriza por segunda. En la figura 5 se puede observar al abdomen
abierto y contenido que fue indicado para mejorar el estado hemodinámico y respiratorio
de este paciente obeso y con enfermedad pulmonar obstructiva crónica; se encuentra en
pleno proceso de granulación, sin malla de contención: la flecha muestra la
comunicación de la retrocavidad con el exterior, de pequeño diámetro debido a la
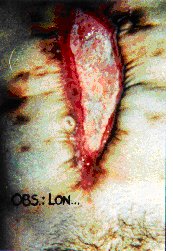
cicatrización por segunda. En la figura 6 el mismo paciente unos meses más tarde.
En una versión posterior de esta técnica, una vez invadido el
retroperitoneo por tejido de granulación se colocan dos gruesos drenajes en la cavidad y
se cierra la pared abdominal. Los drenajes se utilizan para lavar esta cavidad residual en
el postoperatorio. Modificación mediante se ha logrado reducir el promedio de
internación y el número de reexploraciones.
Las complicaciones están relacionadas con el riesgo de hemorragias
graves a nivel retroperitoneal debido a los vasos sanguíneos que quedan expuestos y de
fístulas digestivas por el traumatismo en el cambio del packing. En nuestra experiencia
con los guantes de goma en reemplazo de las gasas, no hemos tenido hemorragias graves.
En el caso de la modificación de la técnica las fístulas digestivas
son mas frecuentes debido al decúbito de los drenajes. La evisceración y la eventración
constituyen otras posibles complicaciones. La mortalidad se redujo a un 14%.
Tanto la intervención propuesta por la Universidad de Ulm como la de
Bradley III presentan frecuentemente fístulas pancreáticas que
curan en todos los casos y una obstrucción duodenal que desencadena un trastorno en el
vaciamiento gástrico. Una diabetes resultado de la pérdida de tejido pancreático suele
constatarse en estos pacientes en el postoperatorio alejado. El abordaje posterior
retroperitoneal de la necrosis infectada invocado por algunos autores no permite una
exploración suficiente del proceso y una toilette adecuada.
 |
 |
| Figura 5 |
Figura 6 |
Rol de los procedimientos
percutaneos
Los drenajes percutáneos han fracasado en el tratamiento de la mayor
parte de las imágenes hipodensas observadas en las TC dinámicas44. Las
laparotomías efectuadas por el fracaso terapéutico de los drenajes percutáneos
demostró la presencia de necrosis infectada. El fracaso se debe a un error de valoración
de la TC en la cual no se sospecha la coexistencia de una necrosis o bien a la falta de
experiencia de algunos radiólogos intervencionistas que creían que con drenajes de 14
French se podían evacuar los tejidos necróticos17-21. La experiencia induce a
pensar que en numerosas ocasiones, la necrosis infectada hallada quirúrgicamente a
posteriori de un drenaje percutáneo es resultado de la contaminación externa de la
necrosis, provocada por dicho procedimiento percutáneo21.
AGRADECIMIENTOS
El autor agradece especialmente a la Sra. Mónica A. de Corbelle
por la confección del original.
BIBLIOGRAFIA
Acosta JM, Rubio Galli OM, Rossi R, et al: Effect
of Duration of Ampullary Gallstone Obstruction on Severity of Lesions of Acute
Pancreatitis. J Am Col Surg, 1997; 184: 499-505.
Aldridge MC, Ornstein M, Glazer G, et al: Pancreatic Resection for Severe Acute
Pancreatitis. Br J Surg, 1985; 72: 796-800.
Ashley SW: Sterile Pancreatic Necrosis: Is Operation Necessary? J Am Col
Surg, 1995; 181: 363-364.
Balthazar EJ, Ranson JHC, Naidich DP, et al: Acute Pancreatitis: Prognostic Value
of CT1. Radiology, 1985; 156: 767-772.
Balthazar EJ, Robinson DL, Megibow AJ, et al: Acute Pancreatitis: Value of CT in
Establishing Prognosis. Radiology, 1990; 174: 331-336.
Beger HG, Bittner R, Block S, et al: Bacterial Contamination of Pancreatic
Necrosis. A prospective Clinical Study. Gastroenterology, 1986; 91: 433-438.
Beger HG, Büchler M, Bittner R, et al: Necrosectomy and Postoperative Local
Lavage in Patients with Necrotizing Pancreatitis: Results of a Prospective Clinical Trial.
World J Surg, 1988; 12: 255-262.
Berger HG, Büchler M, Bittner R, et al: Necrosectomy and Postoperative Local
Lavage in Necrotizing Pancreatitis. Br J Surg, 1988; 75: 207-212.
Block S, Maier W, Bittner R, et al: Identification of Pancreas Necrosis in Severe
Acute Pancreatitis: Imaging Procedures versus Clinical Staging. Gut, 1986; 27:
1035-1042.
Bradley III EL, Allen K: A
Prospective Study of Observation Versus Surgical Intervention in the Management of
Necrotizing Pancreatitis. Am J Surg, 1991; 161: 19-25.
Bradley III E: A
Clinically Based Classification System for Acute Pancreatitis. Summary of the
International Symposium on Acute Pancreatitis, Atlanta, Ga, September 11 Through 13, 1992.
Arch Surg, 1993; 128: 586-590.
Bradley III EL: A
Fifteen Year Experience with Open Drainage for Infected Pancreatic Necrosis. Surg
Gynecol Obst, 1993; 177: 215-222.
Büchler M, Malfertheiner P, Schoetensack C, et al: Sensitivity of Antiproteases,
Complement Factors and C-Reactive Protein in Detecting Pancreatic Necrosis. Results of a
Prospective Clinical Study. Int J Pancreatology, 1986; 1: 227-235.
Corbelle JL, Mautisi D, Pastore R, et al: Relato: Pancreatitis Agudas. Lesiones
Secundariamente Infectadas. Rev Arg Cir, 1994; 66: 153-162.
Davidson ED, Bradley III EL:
"Marsupialization" in the Treatment of Pancreatic Abscess. Surg, 1981;
89: 252-256.
Fagniez PL, Bonnet F, Hannoun S, et al: Traitement des Pancréatites aiguës
Nécrosantes par Dialyse péritonéale. Une étude prospective. Chirurgie, 1982; 108:
719-723.
Feig BW, Pomerantz RA, Vogelzang R, et al: Treatment of Peripancreatic Fluid
Collections in Patients with Complicated Acute Pancreatitis. Surg Gynecol Obst, 1992;
175: 429-436.
Foitzik T, Mithöfer K, Ferraro MJ, et al: Time Course of Bacterial Infection of
the Pancreas and Its Relation to Disease Severity in a Rodent Model of Acute Necrotizing
Pancreatitis. Ann Surg, 1994; 220: 193-198.
Foitzik T, Fernández del Castillo C, Ferraro MJ, et al: Pathogenesis and
Prevention of Early Pancreatic Infection in Experimental Acute Necrotizing Pancreatitis.
Ann Surg, 1995; 222: 179-185.
Gjørup I, Roikjær O, Andersen B, et al: A Double-Blinded Multicenter Trial of
Somatostatin in the Treatment of Acute Pancreatitis. Surg Gynecol Obst, 1992; 175:
397-400.
Hariri M, Slivka A, Carr-Locke DL, et al: Pseudocyst Drainage Predisposes to
Infection When Pancreatic Necrosis is Unrecognized. Am J Gastroenterology, 1994; 89:
1781-1784.
Heath DI, Cruickshank A, Gudgeon M, et al: Role of Interleukin-6 in Mediating the
Acute Phase Protein Response and Potential as an Early Means of Severity Assessment in
Acute Pancreatitis. Gut, 1993; 34: 41-45.
Kane TD, Alexander W, Johannigman JA: The Detection of Microbial DNA in the
Blood. A Sensitive Method for Diagnosing Bacteriemia and/or Bacterial Translocation in
Surgical Patients. Ann Surg, 1998; 227: 1-7.
Kivisaari L, Somer K, Standertskjold-Nordenstam CG, et al: A New Method for
Diagnosis of Acute Hemorrhagic-Necrotizing Pancreatitis Using Contrast-Enhanced CT.
Gastrointestinal Rad, 1984; 9: 27-30.
Larvin M, McMahon M: APACHE II Score for assessment and Monitoring of Acute Pancreatitis. Lancet, 1989; 22:
201-204.
Luiten EJT, Hop WJC, Lange JF, et al: Controlled Clinical Trial of Selective
Decontamination for the Treatment of Severe Acute Pancreatitis. Ann Surg, 1995; 222:
57-65.
Madry S, Fromm D: Infected Retroperitoneal Fat Necrosis Associated with Acute
Pancreatitis. J Am Col Surg, 1994; 178: 277-282.
Mayer AD, McMahon MJ, Corfield AP, et al: Controlled Clinical Trial of Peritoneal
Lavage for the Treatment of Severe Acute Pancreatitis. N Eng J Med, 1985; 312:
399-403.
Mayer AD, McMahon MJ: The Diagnostic and Prognostic Value of Peritoneal Lavage in
Patiens with Acute Pancreatitis. Surg Gynecol Obst, 1995; 160: 507-512.
Norman J, FranzM, Fink GS, et al: Decreased Mortality of Severe Acute
Pancreatitis After Proximal Cytokine Blockade. Ann Surg, 1995, 221: 625-634.
NormanJG, Fink G, Franz M, et al: Active Interleukin-1 Receptor Required for
Maximal Progression of Acute Pancreatitis. Ann Surg, 1996; 223: 163-169.
O’Keefe GE, Gentilello LM, Maier RV: Incidence of Infectious Complicatios
Associated with the Use of Histamine2-Receptor Antagonists in Critically Ill Trauma
Patients. Ann Surg, 1998; 227: 120-125.
Oría A: Adelantos en el Diagnóstico y Tratamiento de la Patología Pancreática
Benigna. Relato Oficial del LX Congreso Argentino de Cirugía. Rev Arg Cir, Número
Extraordinario Año 1989, pag. 45-83.
Oría A, Alvarez Rodríguez J, Chiapeetta Porras L, et al: Prevalencia e
Historia Natural de la Necrosis Pancreática en Enfermos con Pancreatitis Aguda Biliar.
Rev Arg Cir, 1995; 68: 89-95.
Orlando R III, Welch JP, Akbari
CM, et al: Techniques and Complications of Open Packing of Infected Pancreatic
Necrosis. Surg Gynecol Obst, 1993; 177: 65-71.
Paran H, Neufeld D, Mayo A, et al: Preliminary Report of a Prospective Randomized
Study of Octreotide in the Treatment of Severe Acute Pancreatitis. J Am Coll Surg,
1995; 181: 121-128.
Pederzoli P, Bassi C, Vesentini S, et al: A Randomized Multicenter Clinical Trial
of Antibiotic Prophylaxis of Septic Complications in Acute Necrotizing Pancreatitis with
Imipenem. Surg Gynecol Obst, 1993; 176: 480-483.
Pellegrini CA: The Treatment of Acute Pancreatitis: A Continuing Challenge. N
Eng J Med, 1985; 312: 436-438.
Pisters PWT, Ranson JHC: Nutritional Support for Acute Pancreatitis. Surg
Gynecol Obst, 1992; 175: 275-284.
Ranson JHC, Berman RS: Long Peritoneal Lavage Decreases Pancreatic Sepsis in
Acute Pancreatitis. Ann Surg, 1990; 211: 708-718.
Ranson JHC, Balthazar E, Caccavale R, et al: Computed Tomography and the
Prediction of Pancreatic Abscess in Acute Pancreatitis. Ann Surg, 1995; 201: 656-663.
Rattner DW, Legermate DA, Lee MJ, et al: Early Surgical Débridement of
Symptomatic Pancreatic Necrosis Is Beneficial Irrespective of Infection. Am J Surg,
1992; 163: 105-110.
Rau B, Pralle U, Schoenberg MH, et al: Management of Sterile Necrosis in
Instances of Severe Acute Pancreatitis. J Am Coll Surg, 1995; 181: 279-288.
Rotman N, Mathieu D, Anglade MC, et al: Failure of Percutaneous Drainage of
Pancreatic Abscesses Complicating Severe Acute Pancreatitis. Surg Gynecol Obst, 1992;
174: 141-144.
Rotman N, Chevret S, Pezet D, et al: Prognostic Value of Early Computed
Tomographic Scans in Severe Acute Pancreatitis. J Am Coll Surg, 1994; 179: 538-544.
Schmidt J, Hotz HG, Foitzik T, et al: Intravenous Contrast Medium Aggravates the
Impairment of Pancreatic Microcirculation in Necrotizing Pancreatitis in the Rat. Ann
Surg, 1995; 221: 257-264.
Trudel JL, Wittnich C, Brown R: Antibiotics Bioavailability in Acute Experimental
Pancreatitis. J Am Coll Surg, 1994; 178: 475-479.
Uhl W, Büchler M, Malfertheiner P, et al: PMN-Elastase in Comparison with CRP,
Antiproteases, and LDH as Indicators of Necrosis in Human Acute Pancreatitis.
Pancreas, 1991; 6: 253-259.
’Werner J, Schmidt J, Warshaw AL, et al: The Relative Safety of MRI
Contrast Agent in Acute Necrotizing Pancreatitis. Ann Surg, 1998; 227: 105-111.
’Wilmore DW: Polymerase Chain Reaction Surveillance of Microbial DNA in
Critically Ill Patients: Exploring Another New Frontier. Ann Surg, 1998; 227: 10-11.
Wilson C, Heads A, Shenkin A, et al: C-Reactive Protein, Antiproteases and Complement Factors as Objective Markers
of Severity in Acute Pancreatitis. Br J Surg, 1989; 76: 177-181.
Wilson C, Heath DI, Imrie CW: Prediction of Outcome in Acute Pancreatitis: A
Comparative Study of APACHE II,
Clinical Assessment and Multiple Factor Scoring Sistems. Br J Surg, 1990; 77:
1260-1264.

|


